①研究の背景
化学は好きですか?
システム化学科では、授業で学習した事を基に1年生では実習を行う上での器具等の扱い方の基礎を実験を通して行い、2 年生では工業化学の授業で学習した事を基に実験を行い、3年生では大学へ進学したときや就職したときに役立つよう、 主に機械を使った実習を行います。


実験を行ったときには必ず廃液が出ます。これは川や海を汚す原因となり、また毒性があるものだと私たちの健康に影響を与えるものもあります。 実際に、富山県の神通川に工場で使われたカドミウムという金属が回収されずに流れ出て、 カドミウムが入った水で育てた米などを食べた人がイタイイタイ病という病気にかかったということが起きました。 そこで、私たちはそのようなことが起きないように、 排水の処理について研究することにしました。
②仮説とねらい
・廃液を分析し、工業排水(工場や研究室で出てしまう廃液)の成分を知る。
・工業排水が地球におよぼす悪影響を知る。
・廃液から有害物質を私たちの学習分野である化学を使って取り除く。
・ここで学んだ知識をもとに効率の良い廃液処理プロセス(方法、手順)を研究する。
③研究内容
ⅰ.廃液処理装置
浜工にある廃液を処理するための機械を使い実際にその機械を動かして廃液の処理をしました。 中和や酸化、還元などといった化学反応を使い、人間に害があるものを害を無くしたり、川や海などを汚す原因となるものを無くすために行います。 川や海などに流してはいけないものや排水の性質が中性でないといけないなどの環境に配慮した法律※があります。
※環境基本法、地球環境保全法など

ⅱ.半微量法による定性分析
廃液の中にどんな金属が入っているか調べる定性分析(④で説明)という実験をしました。 化学反応によって試験管の中の色が変わる性質を利用して中にはどのようなものが入っているか調べる実験をしました。
廃液を定性分析した実験結果
※族とはそれぞれの金属の性質ごとに分類したものである。
※ ★、反応ありとは廃液にその金属が含まれることを示す。
第一族
☆鉛イオン(Pb²⁺)反応なし(指示薬: 重クロ ム酸カリウム)
☆銀イオン(Ag⁺)反応なし(指示薬: ヨウ化 カリウム)
★銀イオン(Ag⁺)反応あり (指示薬: 硝酸)
第二族
★ビスマスイオン(Bi³⁺)反応あり (アンチピ リン-KI)
★銅イオン(Cu²⁺) 別反応 (シアン化鉄カリウム)
☆カドミウムイオン(Cd²⁺)反応なし (硫化水素)
第三族
☆マンガン(VII)イオン (Mn⁷⁺)反応なし(ビスマス酸ナトリウム)
★鉄イオン(Fe³⁺)反応あり (チオシアン酸 アンモニウム)
☆クロムイオン(Cr³⁺)反応なし (酢酸鉛)
★アルミニウムイオン(Al³⁺) 反応あり (アルミノン試薬)
第四族
★亜鉛イオン(Zn²⁺)反応あり (シアン化鉄 カリウム, ジエチルアニリン)
★マンガン(VII)イオン(Mn⁷⁺)気体発生 (ビスマス酸ナトリウム)
☆コバルトイオン(Co²⁺)反応なし (チオシ アン酸アンモニウム, アミルアルコール)
☆ニッケルイオン(Ni²⁺) 反応なし(ジメチル グリオキシム)
ⅲ.凝集試験
実際にガラスが凝集剤として使えるのか、また凝集剤として最適な物質はなにか実験しました。
実験条件
1.気温:25℃
2.各凝集剤の質量:約1.0g
3.撹拌方法:マグネチックスターラーを使用
4.撹拌時間:急速3分→緩速7分
5.静置時間:10分間
6.pHの調整方法:pH計を使用
7.ろ過方法:吸引ろ過
凝集剤
・酸化アルミニウム(Al₂O₃)
・酸化マグネシウム(MgO)
・酸化カルシウム(CaO)
・二酸化ケイ素(SiO₂)
・【粉末状ガラス】
実験方法
1.ろ紙の質量(g)を量った。
2.ろ過した廃液を200mLとり、500mLビーカーに採取した。
3.【塩基性の場合】 pH11に調整するため 1mol/L-NaOH水溶液を26mLいれた。
【中性の場合】 PH7 に調整するため 0.1mol/L,1mol/L-NaOH水溶液でpH計を用いて調整した。
※酸性条件については、結果が期待できないため行っていない。
3′.pH1,2,4,7,9,11,13に調整するために0.1mol/L,1mol/L-NaOH水溶液でpH計を用いて調整した。
4.各凝集剤を約1gとり、500mLビーカーに入れた。
5.マグネティックスターラーを用いて急速3分間、 緩速7分間撹拌した。
6.ビーカーを10分間静置し、沈殿させた。
7.沈殿を吸引ろ過し乾燥後、電子天秤で秤量した。
8.質量差(g) を凝集量(g)とした。
実験結果
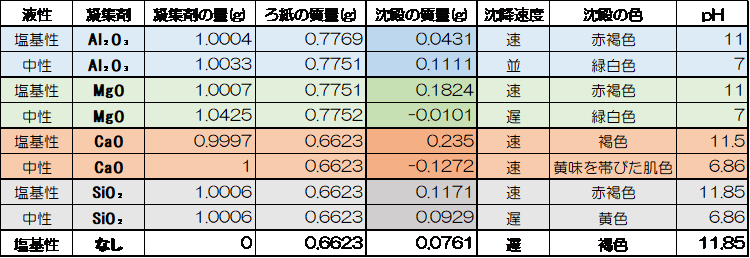
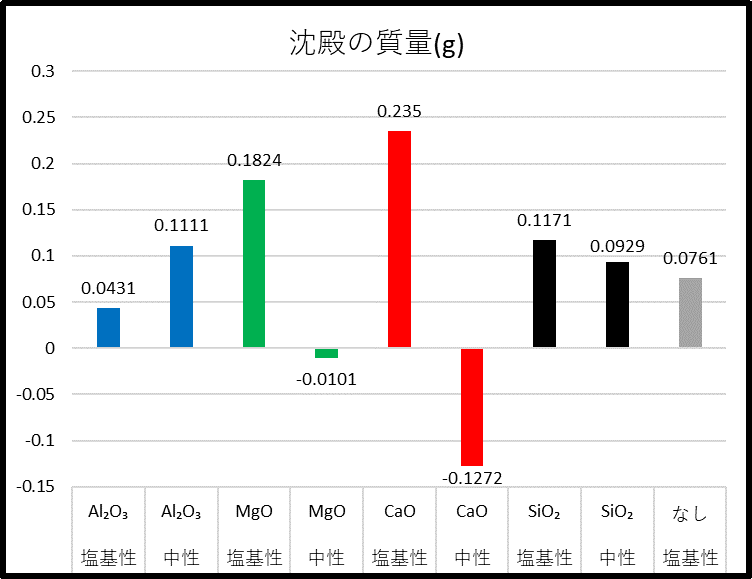
Ⅰ.各凝集剤の凝集効果の違い
Ⅱ.粉末状ガラスとpHの関係
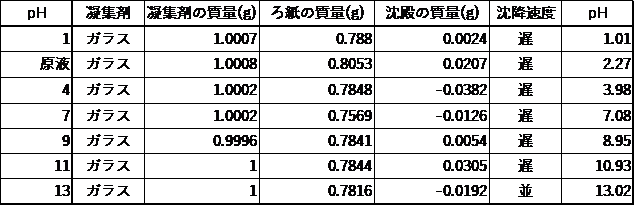

ⅲに対する考察
・Al₂O₃の場合は塩基性より中性条件のとき凝集量が多い。
・CaO、MgOに関しては、塩基性下のほうが凝集効果を発揮する。
・廃ガラスは一般的な凝集剤と比べ凝集作用が低い。
・廃ガラスは塩基性(pH₌11)で最も凝集作用を発揮する。
④技術的知識
Q.定性分析とは?
A.何が入っているかを調べること
指示薬を入れると色が変わる→変色反応


物質を燃やすと色が出る→炎色反応

炎色反応は意外と身近なところで使われていて、花火の青や緑、赤といった色は炎色反応を用いて色を出している。

Q.凝集剤とは?




⑤改善点
・今回実験回数が1回のみであったため、正確性が十分ではなかった。そのため、実験回数を増やす必要がある。
・凝集剤が溶けるということを考慮していなかった。そのため計測方法について変更する必要がある。
・サンプルの液量が少なかったため信憑性に欠ける結果であった。そのため、サンプルの液量を増やすことにより凝集量を増やし誤差の影響を少なくする必要がある。
⑥まとめ
・浜工のシステム化学科では、たくさんの実験を行っている。
・実験では、地球に有害な薬品も扱っている!実験後の廃液には、それらの成分もはいっている。だから、保管や処理をしなければならない。
・廃液には、銀イオン,ビスマスイオン, 銅イオン, アルミニウムイオン, 亜鉛イオン, マンガンイオンが存在している。
・ガラスは凝集効果を有している。
・ガラスの凝集効果は塩基性になるほど高い効果を発揮する。
・これに加えてこれまでの廃液処理プロセスより効率的な廃液処理プロセスを研究していく。
