①研究の背景
我々システム科学科では、実験の際に必ずと言ってもいいほど純水を使用する。純水とはイオンといった不純物が全く含まれていない水のことである。その純水を作るときにはイオン交換樹脂というものを使用する。そこで我々はイオン交換樹脂はどのくらいの量の水をイオン交換できるのか?どのような速さでイオン交換されるのか? 樹脂の再生はできるのか?と疑問に思い、研究をすることにした。
②仮説とねらい
イオン交換樹脂とは端的に言うと水溶液中のイオンを樹脂にくっつけてイオンを取り除くと言うものである。イオン交換樹脂の会社によると、イオン交換樹脂5gあたり5Lの水道水をイオン交換できることが分かっている。なので我々は
・樹脂5gで5Lの水道水をイオン交換できるのではないか?
・一定の速度でイオン交換されるのではないのか?
・イオン交換樹脂の再生は可能なのか?
と考えた。

↑ イオン交換樹脂
③研究内容
まずイオン交換する試料水として、水道水と、コントレックスというMg2+とCa2+を多く含む水、(コントレックスの5倍希釈水)を使用する。
予備実験としてキレート滴定という水溶液中の金属イオンの量がわかる実験を行う。
※このキレート滴定について情報技術科との共同研究を行った。

次に、イオン交換樹脂に水道水、コントレックスを加えイオン交換をする。ビーカーにイオン交換樹脂5gと試料水(水道水は200ml、コントレックスは100ml)を加え、TDSメーターという水溶液中の硬度を導電率として知ることのできる機器を用いて、1分ごとの伝導率を記録する。樹脂は再生のときに使用するため、ティーパックに入れこぼれないようにしておく。また、マグネティックスターラーを用いて攪拌をしたり、樹脂を動かすことにより反応を進めれるようにする。
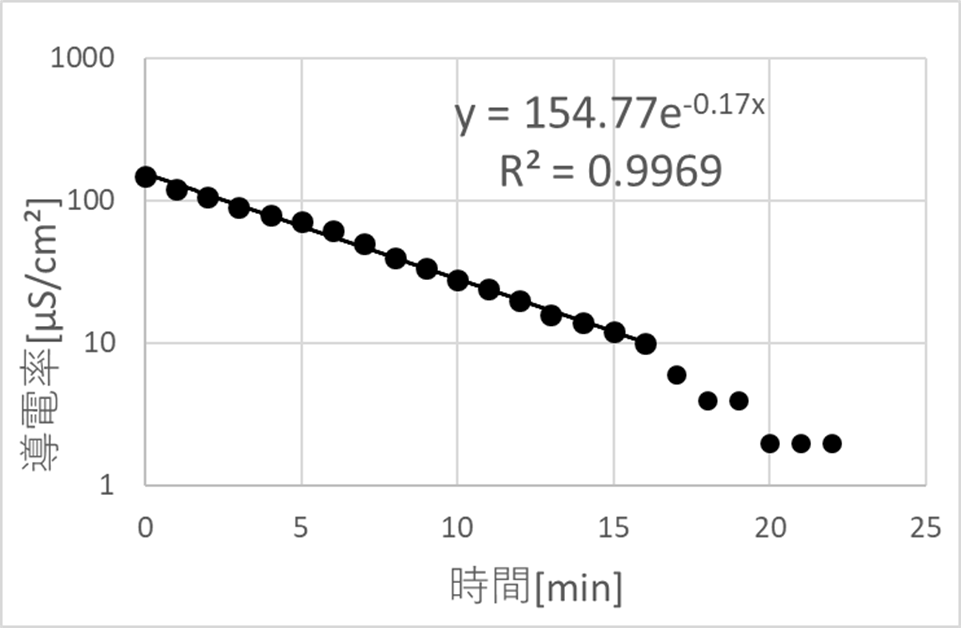
縦軸に導電率、横軸を時間としてイオン交換の速さについてのグラフを作る。このとき純水の導電率は約10[μS/㎠]であるため導電率の値が10[μS/㎠]以下になったらイオン交換され尽くしていると考えられる。

↑ 実際の実験の様子
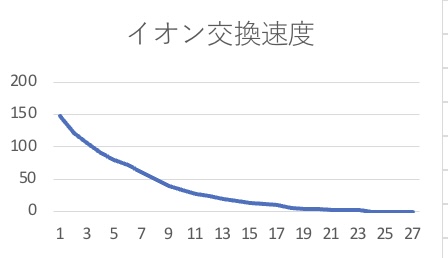
↑縦軸 導電率[μS/㎠]横軸 時間[min]
イオン交換樹脂を再生させるにはまず、陽イオン交換樹脂と陰イオン交換樹脂に分離し、前者なら塩酸、後者なら水酸化ナトリウムを加えて再生する必要がある。
分離方法として陽イオン交換樹脂と陰イオン交換樹脂の比重差を利用して、逆洗を行う。

↑装置の様子
陰イオン交換樹脂の方が比重が小さいので上に集まる。

一方、陽イオン交換樹脂は下に沈殿する。

④研究結果
実験より、樹脂5gあたり3Lの水道水をイオン交換できる。
また、グラフより時間が16[min]のとき導電率が10[μS/㎠]だったため、水道水は16分間のイオン交換で純水となるといえる。
樹脂の再生は分離方法の確立はできたが、時間的な問題で再生まだ行えなかった。

⑤考察
・樹脂5gあたり水道水5000mLを交換できるはずだったが実際は3000mLだった。
これはまだ樹脂がイオン交換可能だったが時間がかかりすぎて実用的にイオン交換できないと考え3000mLのところで計測を終了したのでさらに時間をかければ5000mLまでのイオン交換が可能だと考えることができる。
・時間が経つにつれ交換速度がおそくなるのは、試料水がイオン交換されることで樹脂に触れるイオンが減っていったためイオン交換されずらくなることが原因だと考えることができる。
・今回は樹脂の分離方法まで考えることができたが、樹脂の分離に時間がかかり再生まで辿り着かなかった。樹脂の再生方法は分かっているので機会があれば再生できると考える。
